Трансплантация органов: проблемы настоящего и перспективы
Трансплантация органов является одним из самых важных достижений современной медицины. Из -за трансплантации почк, печени, сердца, легких, тысячи жизней спасаются каждый год.
Для многих пациентов трансплантация является единственным шансом на выживание. Однако, несмотря на достижения, трансплантология по -прежнему сталкивается с рядом серьезных проблем:
- катастрофическая нехватка донорских органов;
- риск иммунного отторжения;
- Сложность в выборе совместимого донора;
- Ограниченный срок работы трансплантированного органа.
Сотни пациентов умирают по всему миру каждый день, не ожидая пересадки. Согласно официальным данным, в США более 100 000 человек находятся в листовке для трансплантации, и около 17 человек, которым не удалось найти донора умирает каждый день. Ситуация похожа в других странах. Даже там, где трансплантации органов работают на высоком уровне, доступность донорского материала весьма ограничена.
Современная трансплантология: что уже возможно
Сегодня трансплантация органов человека -лиц -это обычная медицинская практика во многих странах мира. Наиболее распространенными типами трансплантации являются трансплантация почек, печень, сердце и легкие. Среди них наиболее распространенная трансплантация почки заключается в том, что этот орган может быть пересажен не только от умершего донора, но и от живого человека. В большинстве случаев одной здоровой почки достаточно для нормального функционирования организма, что позволяет нативно или близко к добровольному становится донорами. Печень также обладает способностью регенерировать, поэтому существуют частичные пересадки печени от живых доноров. Пересадка сердца или легких возможна только от мертвого донора, поскольку эти органы жизненно важны.
Об иммунном барьере
Ключевой этап трансплантации состоит в том, чтобы преодолеть иммунный барьер. Иммунная система распознает пересаженную орган как иностранную систему и пытается уничтожить его. Чтобы предотвратить это, пациентам назначают иммунодепрессанты — препараты, которые подавляют активность иммунитета. Эти лекарства должны быть приняты в жизнь, чтобы избежать как острого, так и хронического отторжения. Тем не менее, существует риск инфекций, развитие злокачественных опухолей и побочных эффектов лекарств, но без их трансплантации невозможно.

О успехе пересадки
Успех пересадки, как правило, высокий. Например, согласно United Network для обмена органами (UOS), более 95% пациентов с почечной трансплантированием выжили в течение первого года. Для трансплантации сердца эта цифра составляет около 85-90 %, а для печени — более 90 %.
Однако длительные результаты остаются проблематичными. Около 40 % пересаженных почк отклоняются в течение 10 лет после пересадки. Основными причинами являются хроническое отторжение, постепенное ухудшение функции органа, осложнения от иммуносупрессии или сопутствующих заболеваний. Эти трудности приводят к активному научному поиску способов улучшения качества трансплантации — от улучшения системы отбора доноров до поиска новых методов защиты органов после трансплантации.
Проблемы современной трансплантологии
Несмотря на успехи, трансплантация органов сталкивается с рядом системных, медицинских и этических проблем. Ниже мы посмотрим на основные.
Нехватка донорских тел
Одной из самых острых проблем является глобальная нехватка донорских органов. Причины этого являются медицинские (не все мертвые подходят как для доноров), так и для социальных: отсутствие осведомленности о общественных, юридических ограничениях, религиозных убеждениях или родственников родственников, чтобы дать согласие на посмертное пожертвование.
Проблемы с качеством донорских органов
Даже когда донор найден, не каждый орган подходит для трансплантации. Большая часть доноров — пожилые люди или люди с сопутствующими заболеваниями, такими как диабет, жирный гепатоз, сердечно -сосудистые заболевания. В таких случаях ткани органов уже могут быть затронуты, а их функциональные запасы уменьшаются.
Кроме того, тело может быть повреждено в процессе сбора, транспорта или хранения, что значительно влияет на шансы на его взаимодействие.

Ишемия-реперфузия повреждения
После удаления органа из тела донора он неизбежно испытывает ишемию — состояние, в ходе которого останавливается поставка кислорода и питательных веществ. После пересадки, для восстановления кровотока (реперфузия) ткани подвергаются серьезным стрессу, что вызывает высвобождение свободных радикалов, активацию воспаления, отек и гибель клеток.
Это повреждение ишемии-реперфузии может привести к ухудшению функции организма в первые часы после трансплантации или даже его отказа. Вот почему ученые активно работают над методами защиты органов во время хранения — в частности, использование гипотермической перфузии и антиоксидантных решений.
Проблема хронического отторжения
Если острая отторжение может контролироваться из -за иммуносупрессии, то хроническое отторжение, которое происходит спустя годы после пересадки, все еще остается серьезной проблемой. Он постепенно уменьшает функциональность органа и в конечном итоге приводит к полной потере.
Одной из возможных причин является сложное взаимодействие между клетками врожденного и приобретенного иммунитета, которые сегодня не были хорошо изучены. Это заставляет многих пациентов снова вернуться к ожидающим письмам, часто в худшем состоянии, чем до первой операции.
Ксенотрансплантация: шанс спасти
Ксенотрансплантация — это трансплантация органов или тканей от животного к людям. Идея использования животных в качестве доноров не нова: первые эксперименты датируются началом двадцатого века. Затем почечная ткань кроликов, подкожных имплантатов, сердечных клапанов и других биологических материалов была трансплантирована, но не было попытки перевести жизненно важный орган жизненно важного органа. Основной причиной была острая реакция иммунной системы — инородная ткань немедленно отвергнута.
Идеальные доноры
Первыми кандидатами на роль доноров были приматы — в частности шимпанзе и бабушки. Их органы более совместимы с человеком в контексте иммунитета, но было несколько критических проблем:
- Приматы плохо размножаются в плену;
- Они перечислены в исчезающих видах;
- Их органы не всегда подходят по размеру;
- Высокий риск передачи вирусов, которые легко пересекают межвидовый барьер (например, вирус иммунодефицита приматов — предков ВИЧ).
В конце концов, ученые обратили внимание на свиней. Они оказались идеальными донорами по нескольким причинам:
- Подобные размеры и анатомия органов — сердце, почки и свиньи печени практически идентичны по форме и функции человека;
- быстрое воспроизведение и большое количество потомков;
- простые условия содержания под стражей и короткий период беременности;
- меньше этических возражений по сравнению с использованием приматов;
- Более низкий риск зоонозных инфекций, хотя он не полностью исключен.
Вместе с развитием генной инженерии можно было изменить геном свиньи, чтобы сделать их органы менее иммуногенными, то есть более подходящими для человека.
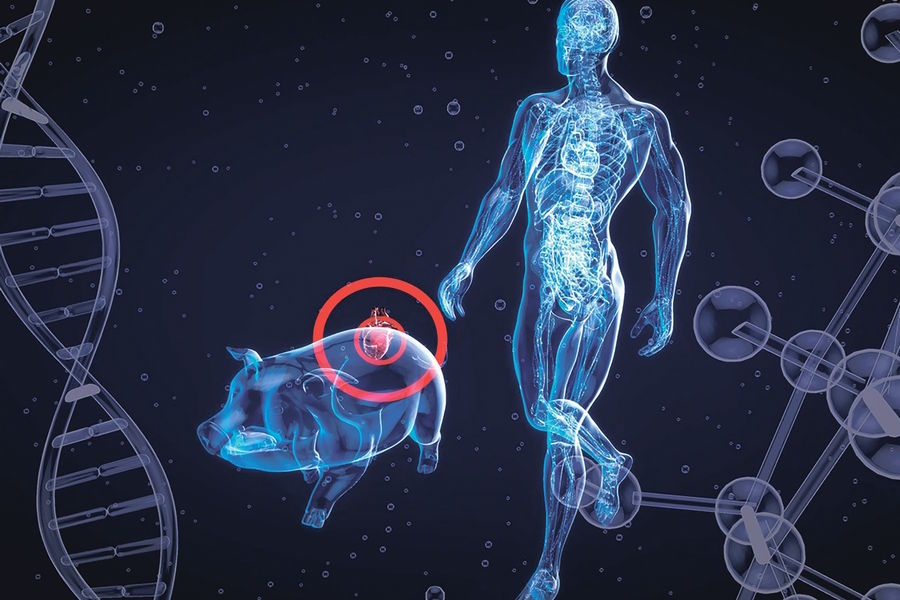
Первые клинические пересадки свиной почки
В 2024 году в Соединенных Штатах были проведены первые три пересадки почки от генетически модифицированных свиней. Все трое были серьезно болены и имели почечную недостаточность, которая нуждалась в регулярном диализе.
Ричард Слмен, 62-летний мужчина, стал первым человеком, получившим почку свиной. Операция состоялась в марте 2024 года в Массачусетской больнице. Первоначально орган успешно укоренился, почка начала функционировать. Однако два месяца спустя, Слеймен умер. Предыдущие данные показывают, что причина смерти не была напрямую связана с трансплантированным телом.
54 -летняя Лайза Пизано стала вторым пациентом. Она также была пересажена почками свиньи, и она впервые функционировала хорошо. Тем не менее, Пинано также умер через два месяца после операции. Врачи отмечают, что эти два случая разрешили впервые в реальном клиническом контексте, чтобы оценить безопасность и эффективность организма свиньи в организме человека.
Самый длинный период функционирования свиной почки был зарегистрирован в случае третьей пациента-Луна Луна, 53-летнего жителя Алабамы. Она была пересажена в ноябре 2024 года. Тело сработало 130 дней — это абсолютная запись для ксенотрансплантации. Тем не менее, у пациента позже была урогенитальная инфекция, и врачи были вынуждены снизить дозу иммунодепрессантов для борьбы с бактериями. В результате защитный ответ иммунитета был усилен и начал атаковать пересаженную почку. Когда функция органа ухудшилась, ее нужно было удалить. Теперь пациент снова находится на диализе и ждет донорского органа (но уже от человека).
Генетическая модификация животных
Трансплантация органов от животных в течение длительного времени оставалась мечтой из -за чрезвычайно сильного иммунного ответа. Чтобы преодолеть это препятствие, ученые обратились к генетической инженерии. Суть подхода состоит в том, чтобы сделать органы свиньи как совместимые с иммунной системой человека. Это достигается за счет редактирования ДНК на уровне эмбриона животных. Современные технологии, такие как CRISPR-CAS9, позволяют вам удалять или вставлять гены, создавая так называемых гуманизированных свиней.
Первым шагом является удаление генов, ответственных за синтез иностранных антигенов на клеточной поверхности. Следующим этапом является введение генов человека, которые регулируют иммунные реакции и свертывание крови. Например, в геноме свиней добавляют гены белков, регулирующих комплемент человека, которые защищают клетки от атак иммунной системы. Это позволяет трансплантированному органу «маскировать» под собственным и функционировать в теле пациента.

Странные органы: человеческие органы внутри животного
Другим амбициозным направлением трансплантологии будущего является создание странных органов, то есть выращиваемого из клеток человека в организме животного. Идея состоит в том, чтобы ввести человеческие стволовые клетки в эмбрион животных (таких как свиньи) на ранней стадии развития. В отличие от ксенотрансплантации, когда орган является чуждым и требует глубокой модификации генов, химера потенциально позволяет вам создавать орган, который как можно ближе к человеку, с минимальным риском отторжения иммунитета.
В 2023 году китайские ученые сделали первый значительный шаг в этом направлении. Они интегрировали стволовые клетки человека в эмбрионы свиней и смогли выращивать почечные рудименты, которые содержали до 50-60 % клеток человека. После 28 дней развития такие эмбрионы образовали органы с полной структурой, включая канальцы — основной функциональный элемент почки.
Это был первый эксперимент, который доказал принцип создания гибридного органа в основном из клеток человека в организме животного. Через 28 дней эмбрионы были уничтожены — это был этический лимит, согласованный с международными стандартами для странных исследований.

Биотехнология будущего: торги и стволовые клетки
В дополнение к ксенотрансплантации и странным органам, наука развивает другой подход параллельно — создание органов с нуля. Речь идет о биодерме органов и использовании стволовых клеток для выращивания функциональных тканей.
О торгах
Торги — это технология, которая позволяет вам создавать объемные живые структуры из биохорнила (гидрогели, содержащие живые клетки). С помощью 3D -принтеров образуется структура ткани, которая повторяет архитектуру истинного органа.
Сегодня уже напечатано:
- Фрагменты кожи для лечения ожогов;
- хрящевая ткань для суставов;
- сердечные клапаны;
- Прототипы сосудов и сетчатки.
Тем не менее, создание полного функционального органа (печень, почки или сердце) остается проблемой. Основной проблемой является необычайная сложность микроструктуры органов. Необходимо не только печатать ткани, но и сформировать капиллярную сетку, которая обеспечит кровоснабжение и питание клеток.
Об органоидах
Стволовые клетки — это универсальные клетки, которые могут превратиться в любой тип ткани. От них можно выращивать органоиды — миниатюрные, но структурно и функционально сходны с реальными, начало органов.
Сегодня ученые смогли создать:
- Мини -запас, способный производить ферменты;
- мини -конуни, у которого есть ворсинка и собственная перистальтика;
- Минимальная активность, которая демонстрирует электрическую активность;
- Моннинги, способные к фильтрации.
Такие органоиды по -прежнему не подходят для пересадки, но они уже активно используются в исследованиях — например, для изучения заболеваний, тестирования на лекарства или иммунных реакций. В будущем органоиды могут стать основой для выращивания полных органов в лаборатории, особенно при комбинировании технологий с биофильсами.













